Технология SRP® является самой современной окислительно-восстановительной технологией и превращает сероводород в безвредную элементарную серу, используя экологически безвредный катализатор на основе хелатного железа.
Основной химизм идентичен для всех трех конфигураций систем SRP®. Процесс SRP® поглощает сероводород, ионизирует его и окисляет до серы, превращает (окисляет) железо, поглощает кислород, затем повторно окисляет железо. Таким образом, сероводород превращается в элементарную серу, при этом используется экологически безвредный катализатор на основе хелатного железа. Железный катализатор удерживается в растворе с помощью органических хелатных добавок, которые охватывают ион железа подобно клешне, предотвращая осаждения сульфида железа (FeS) или гидроксида железа [Fe(OH3)]. Процесс SRP® основан на окислительно-восстановительном химизме. Имеют место две окислительно-восстановительные реакции — одна происходит в секции абсорбера, превращая сероводород в элементарную серу, другая — в секции окислителя — регенерирует катализатор.
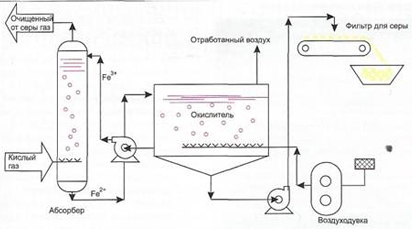
Реакции во внутритрубном абсорбере. В компактном абсорбционном устройстве сероводород абсорбируется в слабощелочной водный раствор системы SRP®. Сероводород ионизируется до бисульфида, который окисляется до серы путем превращения иона железа из трехвалентного в двухвалентное состояние. Превращенные ионы железа затем переносятся из абсорбера в окислитель.
Итак, в абсорбере происходят следующие реакции:
H2S (газ) + Н2O (жидк.) → H2S (жидк.);
H2S (жидк.) → HS — + H +;
HS — + 2 Fe+++ → S° (тверд.) + 2 Fe++ + H+.
Реакции во внутритрубном окислителе. В компактном окислителе атмосферный кислород абсорбируется в раствор системы SRP®. Двухвалентное железо повторно окисляется до трехвалентного железа, регенерируя катализатор. Регенерированный катализатор вновь готов к использованию в секции абсорбера.
Итак, в окислителе происходят следующие реакции:
½ O2 (газ) + Н2O (жидк.) → ½ O2 (жидк.);
½ O2 (жидк.) + 2Fe++ + Н2O → 2Fe+++ + 2OН-.
Общая реакция. Общая реакция представляет собой изотермический, недорогой в эксплуатации метод осуществления модифицированной реакции Клауса. Химические добавки, необходимые для поддержания вышеуказанных реакций, -это щелочь для поддержания уровня рН, замена хелатного железа, потерянного в процессе удаления серы, и замена разрушившихся хелатных добавок.
Общая реакция такова:
Fe
H2S (газ) + ½ O2 (газ)→ Н2O + S°.
Побочные реакции. Как и в любом химическом процессе, в процессе SRP® могут возникнуть побочные реакции. Например, образование тиосульфатов увеличивается, когда в сернистом газе присутствует кислород. Это происходит, когда очищаемый сернистый газ представляет собой воздушный поток или когда сернистый газ загрязнен воздухом. Тиосульфат оказывает некоторое положительное воздействие на процесс, поскольку стабилизирует хелатные добавки, уменьшая их порчу и таким образом сокращая затраты на химикаты. С другой стороны, слишком большое количество тиосульфата требует добавки щелочи для поддержания уровня рН, и в результате для предотвращения накопления солей в системе может потребоваться продувка.
Образование бикарбонатов зависит от количества углекислого газа, абсорбируемого из сернистого газа, которое, в свою очередь, зависит от парциального давления СO2 и от уровня рН в растворе. Образование бикарбоната не имеет никакого полезного эффекта. Необходимо добавлять щелочь для поддержания уровня рН, и некоторое количество СO2теряется.
Эти побочные реакции следующие:
образование тиосульфатов:
2HS- + 2КОН +3/2 O2 → K2S2O3+ 2Н2О;
образование бикарбонатов:
СO2 (газ) + Н2O (жидк.) → Н2СО3 (жидк.);
КОН + Н2СO3 → KHCO3 + Н2О
Запатентованная система SRP® обеспечивает экономически эффективную очистку невзрывных газовых потоков. После удаления сероводорода нейтральный газовый поток вместе с воздухом окисления выпускается в атмосферу.
На рисунке представлена принципиальная технологическая схема установки SRP®: